Inleiding

Heeft deze man een thoracale aortadissectie (AD)? Dat is de vraag die we stelden in onze vorige post over de ‘SAB van de torso’. We leerden toen het volgende over een AD:
- Risicofactoren: een voorgeschiedenis met hypertensie, aorta- en hartchirurgie, en, hoewel zeer zeldzaam, Marfan en andere bindweefselziekten. Niet genoemd in de vorige post, maar ook belangrijk zijn: een familie-anamnese met aortaproblematiek en aortakleplijden.
- Klinische presentatie: scheurende of migrerende pijn is zeldzaam, maar verhogen de positive likelyhood ratio op een AD aanzienlijk. Echter kan een AD zich ook pijnloos presenteren. Zeldzame maar zeer behulpzame klinische tekenen zijn focale neurologische uitval (zeker in combinatie met pijn op de borst), een polsdeficit en hypotensie/shock. Op zichzelf helpen een nieuwe diastolische souffle, de bloeddruk bij presentatie, en een links-rechts tensieverschil (tenzij >20mmHg) je niet veel verder, hoewel een combinatie van voorgaande je verdenking zeker kunnen verhogen.
- Pak de echo: als je een intimaflap ziet, is het beeld behoorlijk specifiek voor een AD (in sommige publicaties tot boven de 90%!). Ook belangrijk om te noemen is dat de specificiteit voor een type B dissectie lager is dan voor een type A (60-83% en 87-96%%, respectievelijk), en dat de negatief voorspellende waarde maar 65% is! Dit komt met name omdat een groot deel van de aorta niet goed af te beelden is met een transthoracale echo.
In deze blogpost gaan we in op een relevante vervolgvraag. Namelijk: het komt vaak voor dat je een patiënt hebt waarbij een AD wel in je differentiaaldiagnose staat, maar de verdenking niet zo hoog is. Wat dan te doen? Iedereen scannen? Of kunnen we een AD met diagnostiek voldoende uitsluiten zonder er ’s nachts van wakker te liggen?
Ja voor CTa!
Allereerst, goed om het volgende punt te maken: wees niet te bang om de radioloog te bellen voor een CTa-aorta! We missen de AD’s nog te vaak, en een CTa is echt het enige antwoord om zeker te weten dat er geen dissectie gaande is. Kijk eens op de THINK AORTA campagnewebsite (https://aorticdissectioncharitabletrust.org/) en je raakt er weer even van doordrongen dat het een moeilijke diagnose is, die ons op het netvlies moet staan.
Aortadissectie is en blijft een moeilijke diagnose en alleen een CTa geeft je een definitief antwoord.
De vervolgvraag
Kan ik bij een lage verdenking een aortadissectie voldoende uitsluiten zonder te scannen, en toch gerust gaan slapen na mijn dienst?
Dan, een antwoord op deze vervolgvraag. Hiervoor gaan we kort kijken naar de ADvISED trial van Nazerian et al. uit 2018 gepubliceerd in Circulation1.
Zij beoordelen daarin de diagnostic performance van het combineren van een pretest probability in de vorm van een klinische risicoscore met het doen van een d-dimeer bij patiënten met een acute aortic syndrome (AAS). Volgens de definitie van de European Society for Cardiologie bestaat AAS uit aortadissectie, intramuraal hematoom, en penetrerend wandulcer2. De bottomline van de ADvISED trial is: AAS is en blijft een moeilijke diagnose en alleen een CTa geeft je een definitief antwoord. Maar, het gebruik van een klinische risicoscore in combinatie met een d-dimeer, naast al je andere diagnostiek, draagt bij aan het onwaarschijnlijker maken van een AAS.
Artikel: Nazerian et al. (2018): de ADViSED trial
Studieopzet
Het onderzoek betreft een multicenter, multinational, prospective, diagnostic accuracy observational study. Data werden verzameld in 6 ziekenhuizen in 4 landen.
Inclusiecriteria
Alle patiënten ouder dan 18 op de SEH waarbij een AAS in de differentiaaldiagnose stond en waarbij deze diagnose dus aangetoond of uitgesloten moest worden.
Exclusiecriteria
Traumapatienten en patiënten die niet mee wilden doen met de trial.
Diagnostische workup en followup (NB: we werken hier niet met een PICO, want dit is een observationele studie!)
Diagnostiek werd ingezet op goeddunken van de behandelend arts en daarna volgde ontslag of opname, al dan niet met OK – navenant de diagnose die was gesteld op de SEH. Bij iedereen die geincludeerd werd, werd een d-dimeer bepaald. Deze was negatief indien <500ng/ml (=0.5mg/L). 14 dagen na eenieders SEH-bezoek werd door 2 klinische experts bekeken of de diagnose (op basis van het patiëntendossier) in retrospect een AAS betrof bij de geincludeerde patiënten of dat er uiteindelijk een andere diagnose uitgekomen was. Deze data werden bekeken in het licht van de pretest probability (dus de berekende risicoscore) op een AAS en de d-dimeer.
Om de pretest probability te bepalen werd gebruik gemaakt van een risicoscore: de aorta dissection detection risk score (ADD-RS), bestaande uit 12 items. In onderstaande tabel kun je de risicoscore inzien. Voor elke kolom waarin de verdachte patient scoort, krijg deze een punt. Afhankelijk daarvan werd een pretest probability toegewezen: ADD-RS = 0 (0 pt), ADD-RS = 1 (1 pt), ADD-RS <1 (0 of 1 pt), ADD-RS >1. (2 of 3 pt).
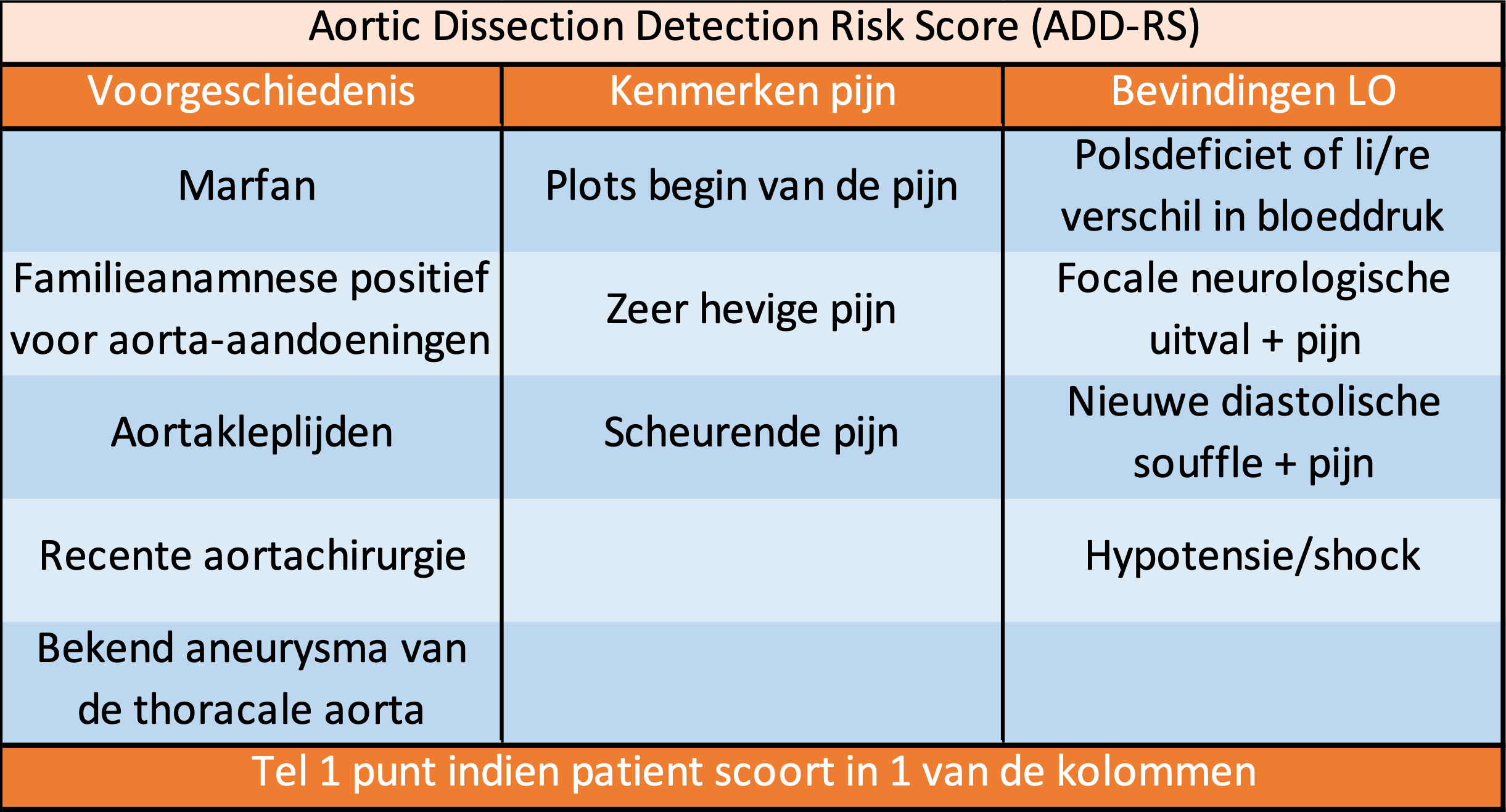
Uitkomstmaten
Primaire uitkomstmaten waren de failure rate (dus in retrospect toch een AAS) in de groep met ADD-RS=0 (0 pt), en de failure rate in de groep met AAD-RS <1 (0 of 1 pt) – beide dus ‘low risk’ groepen. Berekening: aantal AAS diagnoses / aantal patiënten met een negatieve d-dimeer binnen beide low risk groepen.
Secundaire uitkomstmaat was de efficiency van het uitsluiten van AAS binnen voorgenoemde groepen. Berekening: aantal patiënten met een negatieve d-dimeer binnen een groep / aantal geincludeerde patiënten binnen die groep.
Resultaten
- 1850 geincludeerde patiënten
- Patiënten per risicoscore-groep: ADD-RS 0: N=438, ADD-RS 1: N=1071, ADD-RS <1: N=1509, ADD-RS>1: N=341
- In retrospect had 13% van alle patiënten (met beschikbare data) een AAS.
- Primaire uitkomsten:
- ADD-RS=0 & d-dimeer negatief: 294 patiënten, waarvan er toch 1 een AAS had = failure rate van 0.3% (vertaling: 0.3% (1 op de 294) van de mensen waarbij een AAS uitgesloten werd op de SEH obv lage verdenking en negatief d-dimeer was er toch een AAS)
- ADD-RS<1 & d-dimeer negatief: 924 patiënten, waarvan er toch 3 een AAS hadden = failure rate 0.3%
- Secundaire uitkomsten:
- ADD-RS=0 groep: efficiency in het uitsluiten van AAS 15.9%
- ADD-RS<1 groep: efficiency in het uitsluiten van AAS 49.9%
- Nog een interessante bevinding:
- In de hoogste risicogroep was het aantal AAS 5, met een failure rate van 4.4% = bij 1 op de 22 patiënten wordt AAS gemist ondanks een negatief d-dimeer.
Discussie
Dit is een studie met heel duidelijke klinische implicaties voor ons als dokters op de SEH. Het geeft ons iets in handen om grip te krijgen op een moeilijk te diagnosticeren en makkelijk te missen ziektebeeld. Ook is het de eerste studie die kijkt naar de daadwerkelijke impkementatie van een d-dimeer in een diagnostisch algoritme.
De resultaten van deze studie laten duidelijk zien dat het terugkrijgen van een laag d-dimeer bij patiënten met een hogere verdenking je dus niet veiligstelt! 4% van deze mensen heeft alsnog een AAS. Deze mensen moet je dus scannen (ja voor CTa!), tenzij je overtuigd bent van een andere diagnose (en zelfs dan moet je het overwegen, gezien de consequenties van het missen van een AAS).
Interessant is natuurlijk de vraag wat een acceptabele cut off is voor het aantal gemiste AAS. Is 1 op de 300 AAS missen acceptabel bij een ziektebeeld met zo’n hoge mortaliteit? In perspectief: failure rates van 3% zijn in het verleden gehanteerd bij studies naar longembolieen.
Er is ook een aantal zaken op deze studie op te merken. Zo is het een observationele studie met verschillende confounders, er werd niet gekeken naar de inmiddels veelgebruikte age adjusted d-dimeer, er was geen blindering mogelijk voor de betrokken dokters, en de definitieve diagnose die na 14 dagen genoteerd werd (en die werd gebruikt als een soort gouden standaard), werd gesteld op basis van klinische data die bij een deel van de patienten geen beeldvorming bevatte.
Andere studies
De ADvISED trial is niet de enige studie die gekeken heeft naar het combineren van een risicoscore met een d-dimeer in de workup van patiënten met een verdenking op een AAS. Een paar andere studies benoemen we hier kort.
- Gorla et al.3 hebben in 2014 een retrospectieve, single center studie verricht. Hierbij hebben ze retrospectief 376 patiënten geidentificeerd die op de SEH kwamen met pijn op de borst en bij wie aldaar een d-dimeer geprikt was. Bij al deze patiënten hebben ze (dus retrospectief!) een ADD-RS berekend, en gekeken wie er uiteindelijk een AAS had. Zij rapporteren een hoge negatieve voorspellende waarde van 98.9% (en failure rate 1.1%) bij een laag d-dimeer (<500) in de laag-verdachte risicogroep (ADD-RS <1). Echter, de positief voorspellende waarde is maar 21.5%. Groot probleem bij deze studie is natuurlijk de potentieel grote inclusiebias, doordat alleen patiënten geincludeerd zijn bij wie een d-dimeer beschikbaar was. Een mogelijke uiting hiervan is de opvallend hoge incidentie van AAS in de studiepopulatie van 23%. Ook zijn hiermee waarschijnlijk de atypische presentaties van AAS niet geincludeerd geweest.
- Nazerian, de auteur van de ADvISED trial, heeft al eerder geschreven over de het gebruik van een risicoscore en een d-dimeer4. In deze retrospectieve studie (gebaseerd op prospectieve registry data) werden patiënten die op de SEH kwamen en die verdacht werden van een AAS geincludeerd in een registry waarbij d-dimeerwaarde en risicostratificatie-informatie genoteerd werd. Achteraf werd dan een ADD-RS berekend en gekeken naar de incidentie van AAS in het licht van de risicoscore. In de laagrisicogroep (ADD-RS<1) was de negatief voorspellende waarde van een laag d-dimeer 99.2% (en failure rate 0.8%), en de positief voorspellende waarde 25.6%. Omdat bij deze studie geen data is meegenomen van patiënten die niet primair verdacht werden van een AAS, zijn de atypische presentaties waarschijnlijk niet opgenomen in de data.
- De negatief voorspellende waardes van een negatieve d-dimeer bij een lage verdenking lijken hoog. Maar wat bij een hoog d-dimeer? Is er dan sprake van een AAS? Voornoemde positief voorspellende waardes (21.5% en 25.6%, respectievelijk) geven het antwoord: nee, maar in ongeveer een 1/5 van de gevallen is er een AAS en in de andere gevallen is er waarschijnlijk een alternatieve verklaring voor het hoge d-dimeer. Paparella et al.5 betuigen ook precies dat: het d-dimeer is niet altijd verhoogd in patiënten met een dissectie. Zij keken naar d-dimeren in 61 patiënten die een geopereerde AAS hadden en daaruit bleek dat 18% geen verhoogd d-dimeer had (<400 is de afkapwaarde die zij gebruikten). Ook interessant: er leek geen correlatie te bestaan tussen de hoogte van de d-dimeer en de tijd van start van symptomen tot afname d-dimeer.
Conclusie ADvISED trial
De conclusie van de ADvISED trial is: bij een lage verdenking op AAS (risicoscore van <1), en een negatieve d-dimeer (<500ng/ml) is een AAS zeer onwaarschijnlijk. Dit vertaalt zich naar een voorgesteld diagnostisch algoritme, waarbij de ADD-RS als belangrijk beslismoment gehanteerd wordt: indien ADD-RS >1, dan CTa. Indien ADD-RS <1, dan d-dimeer afnemen. Als deze verhoogd blijkt, maak je een CTa, en als normaal, dan is een AAS voldoende uitgesloten.
Bij een lage verdenking op aortadissectie (klinische risicoscore <1) + lage d-dimeer = aortadissectie zeer onwaarschijnlijk, maar niet uitgesloten!
Aansluiting bij de praktijk
De conclusie van het artikel sluit aan bij de bestaande practice guidelines, die we er best vaker op zouden mogen naslaan. De European Society of Cardiology (ESC) heeft een overzichtelijk stroomschema gepubliceerd dat voor een groot deel de door de ADViSED gesuggereerde stappen bevat2 (Figure 6 op pagina 2894, zie referentie en afbeelding alhier). Echter, het ESC stroomschema is een stukje genuanceerder dan dat van de ADvISED trial en neemt ook andere diagnostische modaliteiten mee in de overweging. Dit lijkt meer aansluiting te vinden bij de praktijk, waarbij een patiënt die zich presenteert met thoracale pijn vaak veel meer diagnostiek vereist gezien de doorgaans brede differentiaaldiagnose. In het ESC schema is de eerste vraag (nadat je een STEMI uitgesloten hebt!): heb ik een instabiele of een stabiele patiënt? In het eerste geval maak je zo snel mogelijk een CTa (hoge verdenking op AAS), en in het tweede geval vraag je je af: heb ik een hoge of een lage verdenking op een AAS? Bij een hoge verdenking maak je een transthoracale echo en indien inconclusief een CTa. Bij een lage verdenking doe je een d-dimeer, in combinatie met (vanzelfsprekend) een X-thorax lab, echo. Alles tesamen, dus de risicoinschatting, je batterij aan diagnostiek, en ook je klinische gestalt vormen tesamen je beleid. Om je risicostratificatie te staven kun je gebruik kunnen maken van de ADD-RS.
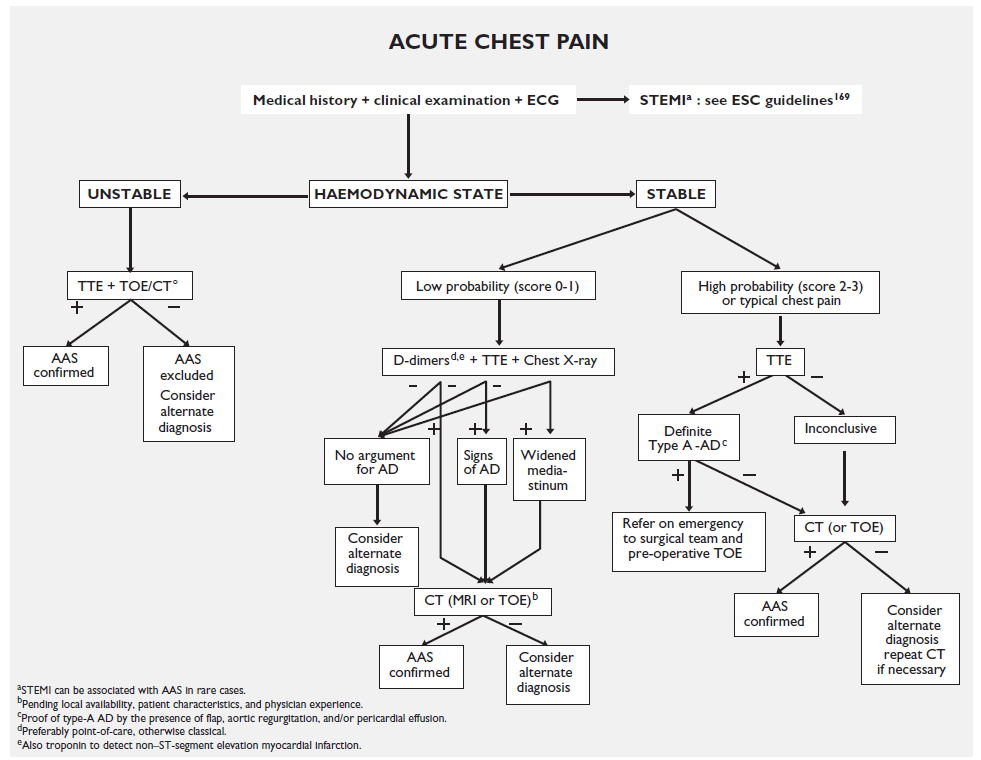
Als laastste voor de praktijk, en ter herhaling: de verdenking op een AAS start pas met het bewustzijn dat de patiënt met pijn op de borst of neurologische uitval een AAS kan hebben! Ofwel: THINK AORTA! En, in navolging van de THINK AORTA campagne: CT scan for a definitive diagnosis.

Key points
- We missen nog te veel aortadissecties, dus als je een hoge verdenking hebt: THINK AORTA! En wees niet bang een CTa te maken. Dat is de enige manier om je te vergewissen dat er geen aortadissectie speelt!
- Bij een patiënt op de SEH die een aortadissectie zou kunnen hebben, gebruik de aortic dissection detection risk score (ADD-RS).
- Indien een lage verdenking (<1), doe een d-dimeer. Indien laag, ga dan in beraad: gebruik ook andere diagnostische onderzoeken (echo, X-thorax, troponine) en vervolg de kliniek. Een aortadissectie is bij een lage d-dimeer en ADD-RS<1 zeer onwaarschijnlijk maar niet onmogelijk.
- Indien een niet-lage score (>1), maak dan een CTa, ook als de radioloog wat overtuigingskracht vergt! Gebruik dan EBM argumenten: vaak atypische presentatie, we missen nog steeds tot 1:4 van de gevallen in de eerste 24 uur! En ja, het number needed to scan is hoog maar wijs dan op de ernstige consequenties van het missen (THINK AORTA campagne).
Referenties
1. Nazerian P, Mueller C, De Matos Soeiro A, et al. Diagnostic accuracy of the aortic dissection detection risk score plus D-dimer for acute aortic syndromes the ADvISED prospective multicenter study. Circulation. 2018;137(3):250-258. doi:10.1161/CIRCULATIONAHA.117.029457
2. Erbel R, Aboyans V, Boileau C, et al. 2014 ESC guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J. 2014;35(41):2873-2926. doi:10.1093/eurheartj/ehu281
3. Gorla R, Erbel R, Kahlert P, et al. Accuracy of a diagnostic strategy combining aortic dissection detection risk score and D-dimer levels in patients with suspected acute aortic syndrome. Eur Hear journal Acute Cardiovasc care. 2017;6(5):371-378. doi:10.1177/2048872615594497
4. Nazerian P, Morello F, Vanni S, et al. Combined use of aortic dissection detection risk score and D-dimer in the diagnostic workup of suspected acute aortic dissection. Int J Cardiol. 2014;175(1):78-82. doi:10.1016/j.ijcard.2014.04.257
5. Paparella D, Malvindi PG, Scrascia G, et al. D-dimers are not always elevated in patients with acute aortic dissection. J Cardiovasc Med. 2009;10(2):212-214. doi:10.2459/JCM.0b013e32831c849e
Auteur: Maartje Melse, SEH-arts KNMGReviewer: Ingvar Berg, SEH-arts KNMG
Met dank aan: Allard Aukema, SEH arts KNMG



Dank voor dit heldere verhaal met directe consequenties voor de dagelijkse praktijk! Zal veel vaker een formele risicoscore gaan doen, goed dat iets dergelijks ontwikkeld is voor dit lastige ziektebeeld.